Resultados em laboratório irão alavancar parcerias com empresas para testes clínicos
Cientistas do Brasil e dos EUA realizaram um estudo sobre terapia gênica para TCF4, um gene associado a várias condições neurológicas e psiquiátricas. Em artigo publicado hoje no periódico Nature Communications, os pesquisadores apresentaram resultados promissores rumo ao desenvolvimento de terapias para a Síndrome de Pitt-Hopkins, condição genética que compartilha algumas características clínicas com os transtornos do espectro autista (TEA) e é ocasionada por mutações no gene TCF4.
“Este gene é de interesse pois há vários distúrbios, como esquizofrenia, depressão, estresse pós-traumático e transtornos do espectro autista, que também estão associados a alterações neste componente genético”, esclarece o Dr. Fabio Papes, um dos coordenadores do estudo e professor do Instituto de Biologia e pesquisador principal do Centro de Química Medicinal, ambos na Unicamp.
Clinicamente, pacientes com a Síndrome de Pitt-Hopkins têm comprometimento cognitivo, atraso motor e constipação crônica. Estes sintomas também podem vir acompanhados de comportamentos típicos dos transtornos do espectro autista. A síndrome foi descrita na década de 1970, mas apenas em 2007 foi estabelecida uma relação direta com mutações no gene TCF4.
“O gene TCF4 controla a fabricação do Fator de Transcrição 4, que tem uma função ainda pouco conhecida nas células. Cada fator de transcrição do ser humano é uma proteína que controla a atividade de vários outros genes, de modo que as consequências de uma mutação em um fator de transcrição podem ser muito complexas”, explica Papes.
Já se sabe que o gene TCF4 é muito ativo em neurônios, logo sua relação com disfunções relacionadas ao neurodesenvolvimento não é inesperada. Entretanto, o modo como as mutações neste gene afetavam o cérebro era pouco conhecido. Ao longo dos últimos 5 anos, os autores estiveram preparando o terreno para a terapia gênica, desvendando as diferenças causadas pelo gene TCF4 no desenvolvimento do tecido cerebral de pacientes.
Para chegar a este ponto, o grupo de pesquisadores utilizou células derivadas de pacientes pediátricos. Uma das vantagens deste tipo de material biológico é verificar os efeitos causados pela mutação no gene TCF4 no contexto genético das células dos próprios pacientes. “Os pesquisadores obtiveram as amostras necessárias para o estudo, cedidas por famílias de crianças com a síndrome, tanto do Brasil quanto dos EUA. Estas famílias acompanharam e comemoraram conosco os resultados positivos”, relata Papes.
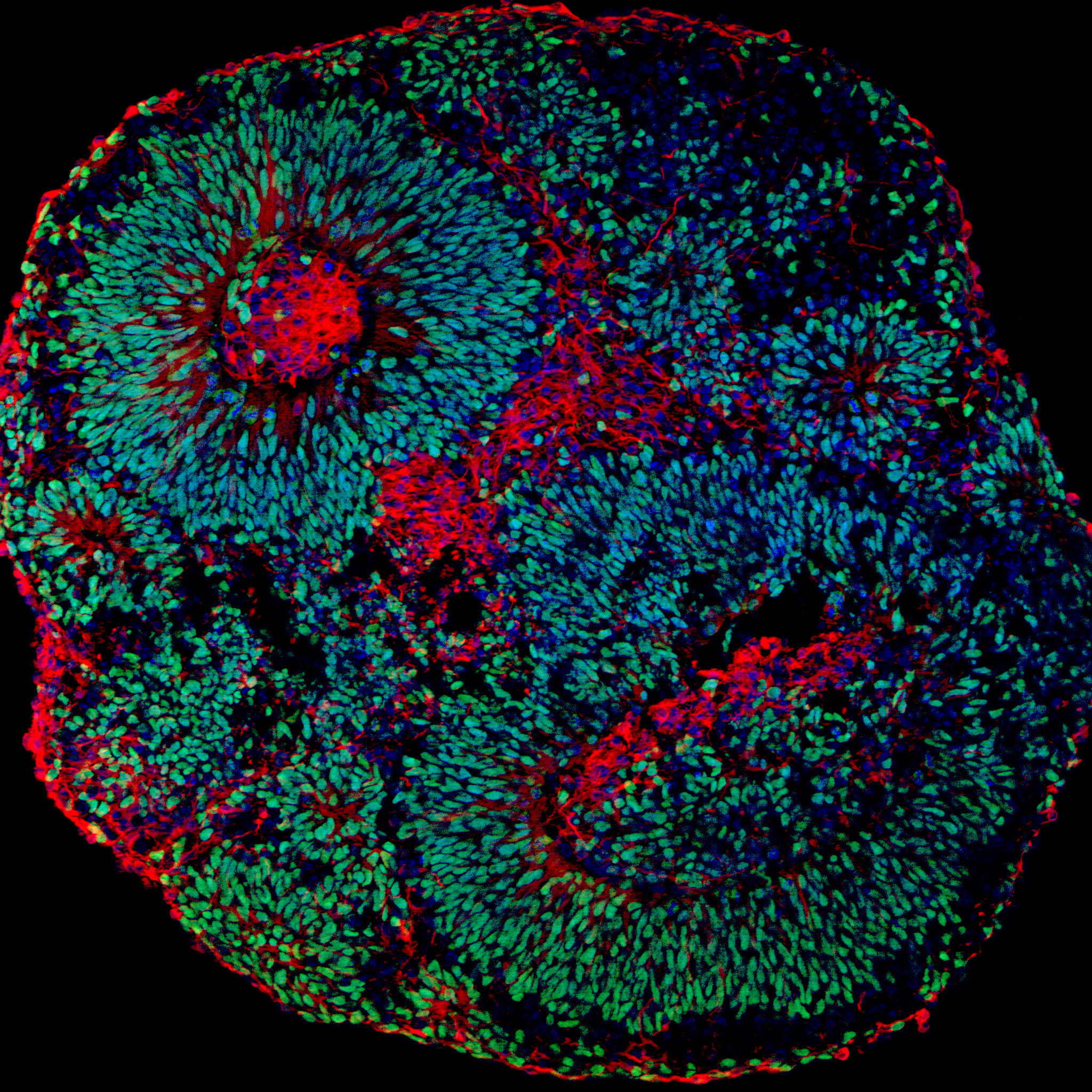
A partir de células da pele dos pacientes, os pesquisadores obtiveram células-tronco, que foram então utilizadas para gerar neurônios e organoides cerebrais – tecido mantido em laboratório que apresenta similaridades com o desenvolvimento do cérebro humano. “As condições genéticas do sistema nervoso em geral são muito difíceis de serem estudadas por falta de um modelo não-invasivo. Os organoides impulsionaram a pesquisa na área”, conta o Dr. Alysson R. Muotri, que é professor da Faculdade de Medicina da Universidade da Califórnia em San Diego (EUA) e supervisionou o estudo juntamente com o professor Papes.
A análise cuidadosa dos organoides derivados de pacientes revelou que as mutações no gene TCF4 levam a redução na quantidade de neurônios. “Encontramos evidências de que algum evento interrompe o processo de especialização das células progenitoras neurais em neurônios”, diz Papes. Além disso, o grupo verificou que os neurônios estudados no laboratório apresentam menor atividade elétrica, uma característica que pode explicar vários dos sintomas clínicos dos pacientes.
Testes de terapia farmacológica
Na tentativa de descobrir métodos para tratamento farmacológico dos distúrbios ligados ao gene estudado, os pesquisadores desvendaram como funciona a Síndrome de Pitt-Hopkins no nível das moléculas. Esta abordagem resulta na identificação de alvos, que podem então ser “atacados” pela aplicação de fármacos. Através da análise de dados de atividade gênica em neurônios e organoides, os pesquisadores constataram que as mutações no TCF4 acarretam alterações de uma importante via de controle da proliferação celular, conhecida como via WNT. “Genes desta via são bastante estudados em virtude de seu papel em inúmeros tipos de câncer, o que favoreceu a pesquisa devido à ampla disponibilidade de substâncias capazes de modificar farmacologicamente a via WNT”, explica o autor Antonio Camargo, um dos pesquisadores do time da UNICAMP.
A aplicação de um composto específico sobre células e organoides no laboratório foi capaz de ativar a via WNT e corrigir os efeitos danosos da mutação genética, aumentando a quantidade de neurônios no tecido afetado. “Foi uma recuperação notável das características do tecido neural derivado dos pacientes”, explica Papes. A molécula específica utilizada pelos pesquisadores não pode ainda ser empregada em pacientes, mas estudos pré-clínicos e clínicos vão agora procurar por moléculas semelhantes e que tenham ação efetiva nos pacientes, relatam os pesquisadores. “Por ora, o uso desta molécula nos ajuda a compreender o que está acontecendo dentro das células nervosas dos pacientes com a síndrome”, explica Papes.
Terapia gênica
A terapia gênica pode ser empregada para corrigir a atividade ou ação de um gene mutado. Alguns tipos de terapia gênica já estão em uso em pacientes ou em fase de testes clínicos para outras doenças. Métodos de terapia gênica incluem a completa substituição do gene mutado nas células afetadas, a introdução de uma cópia extra e inalterada do gene ou o aumento da atividade de uma das cópias do gene do próprio paciente.
“Nem sempre a substituição completa do gene mutado é possível, por causa do grande tamanho de certos genes ou pelo fato de os pacientes apresentarem grandes alterações no cromossomo”, explica Papes. Algumas crianças com a Síndrome de Pitt-Hopkins, por exemplo, possuem grandes mudanças no cromossomo que contém o gene TCF4.
Na pesquisa publicada hoje, os pesquisadores testaram outras abordagens, fazendo uso de métodos que empregam vírus para entregar às células disfuncionais os pedaços de DNA necessários à terapia gênica. “Para o funcionamento correto do gene TCF4, são necessárias duas cópias em cada célula, ou seja, dois alelos funcionando normalmente. Porém, no caso da Síndrome de Pitt-Hopkins, um dos alelos não funciona. Então, adicionamos uma terceira cópia do gene, para compensar o alelo mutado”, conta Papes. “A síndrome não é causada pelo alelo defeituoso, mas sim porque as células não têm dois alelos funcionando suficientemente”, complementa o autor.
Outro método de terapia gênica leva o gene do próprio paciente a ter sua atividade aumentada nas células afetadas, compensando pela ausência de duas cópias funcionais do gene. Os autores conseguiram realizar esta façanha utilizando a tecnologia CRISPR para direcionar uma proteína ativadora para a região do genoma que controla a expressão do gene TCF4. Segundo o estudo, esta abordagem resultou na ativação do TCF4, tanto em células neurais como em organoides cerebrais, corrigindo, portanto, a menor expressão do fator de transcrição no tecido.
Os resultados da aplicação das duas abordagens entusiasmaram os pesquisadores. Os organoides dos pacientes que passaram pela terapia gênica apresentaram uma quantidade corrigida de neurônios e estas células demonstraram atividade elétrica semelhante à do tecido não afetado.
Avanços e Expectativas para o Futuro
Os organoides utilizados pela equipe liderada por Papes e Muotri são semelhantes ao cérebro em desenvolvimento. Além disso, são muito mais similares ao cérebro humano do que o tecido nervoso de animais utilizados como modelo. “O cérebro de um camundongo leva 22 dias para ficar pronto e o nosso, nove meses”, frisa Muotri. Porém, organoides não são versões em miniatura do cérebro humano. Por exemplo, estas estruturas in vitro não são naturalmente vascularizadas e não têm a diversidade de células presentes no cérebro. Ainda assim, o uso de organoides possibilita fazer testes que seriam impossíveis em cérebros de crianças ou adultos. “É um tecido ainda imperfeito, mas é o melhor modelo para estudar neurociência humana de forma não invasiva. Estimamos que, em dois ou três anos, teremos organoides vascularizados, o que vai aprimorar ainda mais o modelo”, complementa Muotri.
Além disso, embora a terapia gênica tenha rendido resultados promissores nos experimentos de prova-de-conceito desenvolvidos pelo grupo, ainda é preciso testar diferentes variações do método em ensaios pré-clínicos e clínicos extensivos, para garantir a segurança de sua aplicação em pacientes. “Ainda não foi realizada nenhuma terapia gênica visando o cérebro humano. Mas a ideia é avançar cada vez mais para garantir a segurança da terapia. Estamos sendo pioneiros em terapia genética para o cérebro e esperamos abrir portas para outras condições neurológicas”, aponta Muotri.
Uma outra possibilidade vislumbrada pelos pesquisadores é explorar a terapia gênica tendo como alvo as células do sistema motor dos pacientes com a síndrome. “Se conseguirmos tratar estas crianças para alcançar um ganho na capacidade motora, será um avanço importante para elas e suas famílias”, considera Papes.
Agora a pesquisa caminha para a etapa clínica. Os pesquisadores já fecharam parceria com uma empresa especializada em terapia gênica, que licenciou a tecnologia e já iniciou a produção em larga escala dos reagentes necessários aos testes clínicos da metodologia, com padrão de controle de qualidade necessário ao uso em pacientes.
“A parte mais importante vem agora. Estou muito ansioso para ver nossa ciência resultar em qualidade de vida para as crianças e suas famílias”, finaliza Papes.
Sobre a pesquisa
A pesquisa foi desenvolvida no Laboratório de Genômica e bioEnergia (LGE) e no Centro de Química Medicinal da UNICAMP (CQMED) e também no Sanford Consortium for Regenerative Medicine da Universidade da Califórnia em San Diego. A pesquisa contou com financiamentos da FAPESP (Auxílio Regular 2020/11451-7), do NIH (National Institutes of Health, EUA) e da Pitt-Hopkins Research Foundation.
IMAGEM: Imagem de microscopia mostrando o aspecto de um organoide cerebral derivado de células humanas. As células em verde são os progenitores de neurônios e as células em vermelho são os neurônios. Foto: Fabio Papes


